A. Pengertian
- Cepat lambatnya suatu reaksi kimia berlangsung
- Perubahan konsentrasi reaktan atau produk per satuan waktu
- Laju berkurangnya konsentrasi reaktan atau bertambahnya konsentrasi produk per satuan waktu.
- Satuannya : M/s
Keterangan :
- V = laju reaksi (M/s)
- ∆[A] = perubahan konsentrasi reaktan A (M)
- ∆[B] = perubahan konsentrasi produk B (M)
- ∆t = perubahan tiap satuan waktu (s)
B. Konsentrasi
(Molaritas = M) : jumlah mol zat terlarut dalam 1 liter
larutan.
C. Hubungan
Laju Reaksi dengan Koefisien Reaksi
D. Teori
Tumbukan
Reaksi kimia hanya dapat
terjadi jika ada tumbukan efektif. Syarat tumbukan efektif :
- Posisi tumbukan antar molekul harus tepat
- Energinya cukup untuk memutus ikatan molekul reaktan
E. Energi
Aktivasi (Ea)
Energi minimum yang
dibutuhkan agar suatu reaksi kimia dapat berlangsung.
F. Faktor
yang Mempengaruhi Laju Reaksi
1. Konsentrasi Reaktan
Semakin BESAR konsentrasi
reaktan → semakin banyak jumlah partikel molekul reaktan → kemungkinan tumbukan efektif semakin besar → laju reaksi CEPAT.
2. Luas Permukaan Bidang
Sentuh
Semakin KECIL ukuran
partikel → luas permukaan bidang sentuh
semakin besar → kemungkinan tumbukan efektif semakin besar → laju reaksi CEPAT.
3. Suhu
Semakin TINGGI suhu → energy
kinetic semakin besar → kemungkinan tumbukan efektif semakin besar → laju reaksi CEPAT.
4. Katalis
Zat yang mempercepat
reaksi kimia dan dihasilkan kembali diakhir reaksi
Adanya katalis menurunkan
energi aktivasi (Ea) sehingga laju reaksi menjadi CEPAT.
G. Persamaan
Laju dan Orde Reaksi
aA + bB → cC + dD
Persamaan laju / hukum laju
: v = k [A]x[B]y
Keterangan :
V = laju reaksi (M/s)
K = tetapan laju reaksi
[A] = konsentrasi reaktan
A (M)
[B] = konsentrasi reaktan
B (M)
X = orde reaksi terhadap
A
Y = orde reaksi terhadap
B
Orde reaksi TIDAK SAMA
DENGAN koefisien reaksi.
Orde reaksi ditentukan
melalui percobaan.
Contoh :
Hasil percobaan penentuan
laju reaksi H2 dan NO pada 800oC
Tentukan :
- Orde reaksi terhadap H2
- Orde reaksi terhadap NO
- Orde reaksi total
- Persamaan laju reaksi (v)
- Tetapan laju reaksi (k)
Jawab :
1. Mencari orde reaksi
terhadap H2 → pilih [H2] yang beda, [NO] sama (Percobaan
1 dan 2)
2. Mencari
orde reaksi terhadap NO → pilih [NO] yang beda, [H2] sama (Percobaan
2 dan 3)
3. Orde
reaksi total = x + y = 1 + 2 = 3
4. Persamaan
laju reaksi :
v
= k [A]x[B]y
v
= k [H2][NO]2
5. Tetapan
laju reaksi (k) : ambil data salah satu percobaan (misalnya data 1)
H. Grafik
Orde Reaksi
A. Orde nol
v = k[A]0
Perubahan [reaktan] tidak
mempengaruhi laju reaksi
B. Orde
satu
v = k[A]
Perubahan
[reaktan] berbanding lurus (linier) dengan laju reaksi
Jika
[] dinaikkan 2x maka laju reaksi menjadi 2x lebih cepat
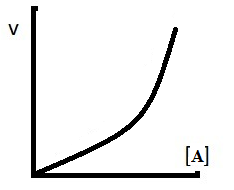
C. Orde dua
v = k[A]2
Perubahan [reaktan]
berbanding kuadrat dengan laju reaksi
Jika [] dinaikkan 2x maka
laju reaksi menjadi 4x lebih cepat
Laju Reaksi
 Reviewed by ChemEduMedia
on
Mei 30, 2020
Rating:
Reviewed by ChemEduMedia
on
Mei 30, 2020
Rating:
 Reviewed by ChemEduMedia
on
Mei 30, 2020
Rating:
Reviewed by ChemEduMedia
on
Mei 30, 2020
Rating:
















Tidak ada komentar: